 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
根据和Hg2Cl2的Ksp,计算。如溶液中Cl-浓度为0.010mol·L-1,Hg2Cl2/Hg电对的电势为多少?
根据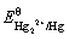 和Hg2Cl2的Ksp,计算
和Hg2Cl2的Ksp,计算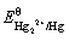 。如溶液中Cl-浓度为0.010mol·L-1,Hg2Cl2/Hg电对的电势为多少?
。如溶液中Cl-浓度为0.010mol·L-1,Hg2Cl2/Hg电对的电势为多少?
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
根据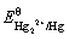 和Hg2Cl2的Ksp,计算
和Hg2Cl2的Ksp,计算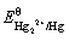 。如溶液中Cl-浓度为0.010mol·L-1,Hg2Cl2/Hg电对的电势为多少?
。如溶液中Cl-浓度为0.010mol·L-1,Hg2Cl2/Hg电对的电势为多少?
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“根据和Hg2Cl2的Ksp,计算。如溶液中Cl-浓度为0.0…”相关的问题
更多“根据和Hg2Cl2的Ksp,计算。如溶液中Cl-浓度为0.0…”相关的问题
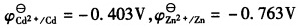 ,离子的活度系数均为1,溶液的pH保持中性。)通过计算回答下面的问题: (1)哪种金属首先在阴极上析出? (2)第二种金属开始析出时,前一种金属剩下的浓度为多少? (3)当H2开始析出时,溶液中残留的两种金属的浓度各为多少?
,离子的活度系数均为1,溶液的pH保持中性。)通过计算回答下面的问题: (1)哪种金属首先在阴极上析出? (2)第二种金属开始析出时,前一种金属剩下的浓度为多少? (3)当H2开始析出时,溶液中残留的两种金属的浓度各为多少?
计算pH=10.0,总浓度为0.10mol·L-1NH3-NH4Cl缓冲溶液中Ag+/Ag电对的条件电势。 =0.80V,
=0.80V, 的lgβ[1=3.24,lgβ2=7.05,pKb(NH3)=4.74;忽略离子强度及形成
的lgβ[1=3.24,lgβ2=7.05,pKb(NH3)=4.74;忽略离子强度及形成 络合物的影响]
络合物的影响]
分别计算0.100mol·L-1KMnO4和0.100mol·L-1K2Cr2O7在H+浓度为1.0mol·L-1介质中,还原一半时的电势。计算结果说明什么?(已知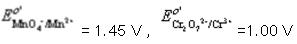 。)
。)
[已知(PbCl2)=1.6×10-5,M(NaCl)=58.5g·mol-1]
A.-0.0886V;
B.-0.1772V;
C.0.0276V;
D.0.0452V。

的标准平衡常数.当H2AsO3和I-的浓度为1.0mol·L-1.该反应正、负极电极电势相等时,溶液的pH为多少?
A.35%
B. 40%
C. 45%
D. 50%
PbSO4的Ksp可用如下方法测得:选择Cu2+/Cu,Pb2+/Pb两电对组成一个原电池,在Cu2+/Cu半电池中使c(Cu2+)=1.0mol·L-1,在Pb2+/Pb半电池中加入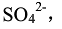 ,产生PbSO4沉淀,并调至
,产生PbSO4沉淀,并调至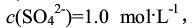 。实验测得电动势E=0.62V(已知铜为正极),计算PbSO4的Ksp。
。实验测得电动势E=0.62V(已知铜为正极),计算PbSO4的Ksp。
A.AgCl、AgBr、Agl
B.Agl、AgBr、AgCl
C.Agl、AgCl、AgB
D.不能判断(Ksp(AgCl)=15.6×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Agl)=1.5×10-16)