 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
分别计算0.100mol·L-1KMnO4和0.100mol·L-1K2Cr2O7在H+浓度为1.0mol·L-1介质中,还原一半时的电势。计算结果说
分别计算0.100mol·L-1KMnO4和0.100mol·L-1K2Cr2O7在H+浓度为1.0mol·L-1介质中,还原一半时的电势。计算结果说明什么?(已知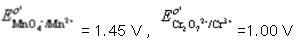 。)
。)
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
分别计算0.100mol·L-1KMnO4和0.100mol·L-1K2Cr2O7在H+浓度为1.0mol·L-1介质中,还原一半时的电势。计算结果说明什么?(已知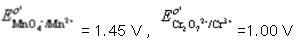 。)
。)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“分别计算0.100mol·L-1KMnO4和0.100mol…”相关的问题
更多“分别计算0.100mol·L-1KMnO4和0.100mol…”相关的问题
A、反应速度为最大反应速度一半时的酶浓度
B、反应速度为最大反应速度一半时的底物浓度
C、反应速度为最大反应速度一半时的温度
D、反应速度为最大反应速度一半时的抑制浓度
E、是达到最大反应速度所必需的底物浓度的一半
A.反应速度是指为最大速度一半时的底物浓度
B.反应速度是指为最大速度一半时的酶浓度
C.反应速度是指为最大速度一半时的温度
D.反应速度是指为最大速度一半时的抑制剂浓度
E.以上都不是
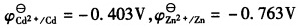 ,离子的活度系数均为1,溶液的pH保持中性。)通过计算回答下面的问题: (1)哪种金属首先在阴极上析出? (2)第二种金属开始析出时,前一种金属剩下的浓度为多少? (3)当H2开始析出时,溶液中残留的两种金属的浓度各为多少?
,离子的活度系数均为1,溶液的pH保持中性。)通过计算回答下面的问题: (1)哪种金属首先在阴极上析出? (2)第二种金属开始析出时,前一种金属剩下的浓度为多少? (3)当H2开始析出时,溶液中残留的两种金属的浓度各为多少?
根据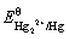 和Hg2Cl2的Ksp,计算
和Hg2Cl2的Ksp,计算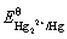 。如溶液中Cl-浓度为0.010mol·L-1,Hg2Cl2/Hg电对的电势为多少?
。如溶液中Cl-浓度为0.010mol·L-1,Hg2Cl2/Hg电对的电势为多少?
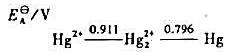
①在酸性介质中Hg22+能否发生歧化反应?
②计算反应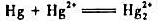 的平衡常数Kθ;
的平衡常数Kθ;
③拟使Hg(I)歧化为Hg(II)和Hg,应该怎样做?试举两个实例加以说明。
[已知(PbCl2)=1.6×10-5,M(NaCl)=58.5g·mol-1]
A.Km是酶的特征性常数
B.Km值与酶的结构有关
C.Km值与酶所催化的底物的种类有关
D.Km值等于反应速度为最大速度一半时的酶的浓度
E.Km值等于反应速度为最大速度一半时的底物浓度