 更多“晶体的熔点:原子晶体 >离子晶体 >分子晶体。()”相关的问题
更多“晶体的熔点:原子晶体 >离子晶体 >分子晶体。()”相关的问题
A.CO2的原子晶体和分子晶体互为同素异形体
B.在一定条件下,CO2原子晶体转化为分子晶体是化学变化
C.CO2的原子晶体和CO2分子晶体具有相同的物理性质
D.CO2的原子晶体中,每个碳周围结合4个氧原子,每一个氧原子跟两个碳原子相结合
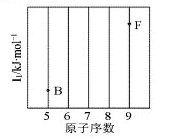
A.离子晶体的晶格能越大,离子晶体的熔点越高
B.碘单质在水中溶解度很小,但在CCl 4 中溶解度很大,这是因为CCl 4 和I 2 都是非极性分子,而H 2 O是极性分子
C.成键原子的原子轨道重叠越多,共价键越牢固
D.含有金属阳离子的晶体一定是离子晶体
A.金属晶体和离子晶体都能导电
B.在镁晶体中,一个镁离子只与两个价电子存在强烈的相互作用
C.金属晶体和离子晶体都可采取“紧密堆积”方式
D.金属晶体和离子晶体中分别存在金属键和离子键等强烈作用,很难断裂,因而都具有延展性


 如果结果不匹配,请
如果结果不匹配,请 
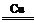 NF3+3NH4F
NF3+3NH4F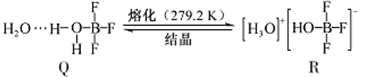
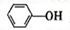 )具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子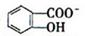 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。















