希赛网为考生整理了2024年中级通信工程师动力与环境背诵本,以下为2024年中级通信工程师动力与环境背诵本知识点:铅酸蓄电池的工作原理。
铅蓄电池正极板上的活性物质是( ),负极板上的活性物质是( )。在稀硫酸溶液中,由于电化学作用,正负极板与电解液之间分别产生了电极电位,正负两极间电位差就是蓄电池的( )。
稀硫酸在水中被电离为氢离子(H+)和硫酸离子(SO42-)。当负极板侵入硫酸溶液后,负极板的铅的二价离子进入溶液,在板极上留下能够自动移动的电子,因而负极带负电。同样,正极板上的二氧化铅与稀硫酸作用,产生四价(Pb4+)留在极板上,使正极板带正电,这样在电池的两极上产生了电势。
1.电化学反应原理
铅酸蓄电池的电化学反应原理是,充电时将电能转化为化学能,在电池内储存起来,放电时将化学能转化电能供给外系统。
放电:是蓄电池将储存的化学能转变为电能向外电路输出的过程。如图3-5所示,此时正极板上的活性物质二氧化铅(PbO2)和负极板上的活性物质铅(Pb)分别与电解质稀硫酸(H2 SO4)发生还原反应和氧化反应,生成硫酸铅(PbSO4)和水(H2 O)。
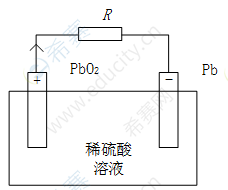
表3-5 铅酸蓄电池的放电示意图
充电:利用外来直流电源(整流器,其输出的正、负端应分别与蓄电池的正、负极相连)向蓄电池输送电能,它是放电的逆过程,此时蓄电池将电能转化为化学能存储起来,如图3-6所示。在此过程中正,负极板上的硫酸铅(PbSO_4)和水(H_2 O)在电流的作用下在正极发生氧化反应。在负极发生还原反应,还原出极板上的活性物质二氧化铅(PbO_2)和Pb,同时存在水分解反应,充电到末期时正极开始析出( ),负极开始析出氢气。
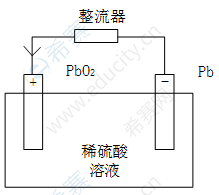
表3-6 铅酸蓄电池的充电示意图
2.副反应
蓄电池放电至放电终止电压时,应停止放电。否则,蓄电池过量放电,容易使极板硫酸盐化,充电时极板上活性物质能恢复,将导致蓄电池容量减少,寿命缩短。所谓放电终止电压(也称为放电终了电压)是指蓄电池以一定的放电率放电至能再反复充放电正常使用的最低电压。
铅蓄电池在充电后期,由于正负极板的活性物质大部分已经恢复,若再继续充电,充电电流会起分解水的作用,使正极析出氧气,负极析出氢气。水的分解使电解液减少,同时浪费了电能,缩短了蓄电池的使用寿命。因此,在充电后期必须减小充电电流,减缓冒气的剧烈程度,以延长电池的寿命。
3.铅酸蓄电池型号
根据国家标准JB/T259—2012,我国铅酸蓄电池型号由3部分组成,分别是:串联的单体电池数、电池的类型与特征、额定容量。如图3-7所示。
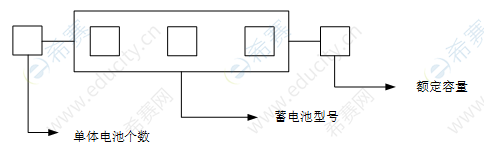
图3-7 铅酸蓄电池的型号命名方法
热门:2025年通信工程师证书领取时间 | 通信工程师学习包-高效备考
推荐:2026年通信工程师考试时间 | 2026年通信工程师报名时间
备考:通信历年真题在线自测 | 通信备考资料免费下载 | 通信课程免费试听
通信工程师考试报名 扫码咨询↓
