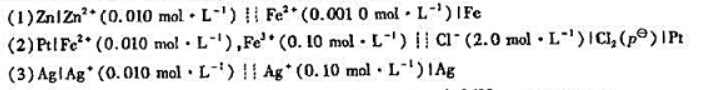题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
298K时,在Ag+/Ag电极中加入过量I-,设达到平衡时c(I-)=0.1mol·dm-3,而另一电极为Cu2+/Cu,c(Cu2+)=0.01mol·dm
298K时,在Ag+/Ag电极中加入过量I-,设达到平衡时c(I-)=0.1mol·dm-3,而另一电极为Cu2+/Cu,c(Cu2+)=0.01mol·dm-3,将两电极组成原电池,写出原电池符号、电池反应,并求电池反应平衡常数。
已知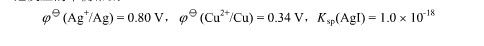
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“298K时,在Ag+/Ag电极中加入过量I-,设达到平衡时c…”相关的问题
更多“298K时,在Ag+/Ag电极中加入过量I-,设达到平衡时c…”相关的问题
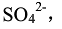 ,产生PbSO4沉淀,并调至
,产生PbSO4沉淀,并调至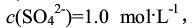 。实验测得电动势E=0.62V(已知铜为正极),计算PbSO4的Ksp。
。实验测得电动势E=0.62V(已知铜为正极),计算PbSO4的Ksp。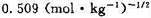 。试求:(1)电极反应和电池反应;(2)电池的标准电动势
。试求:(1)电极反应和电池反应;(2)电池的标准电动势 (要考虑γ±的影响);(3)按电池反应有2个电子得失,当反应进度为1mol时的
(要考虑γ±的影响);(3)按电池反应有2个电子得失,当反应进度为1mol时的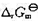 .
.