 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
铜与稀硝酸反应的离子方程式
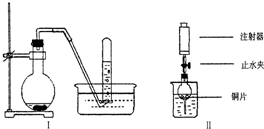
| 下图是铜与稀硝酸反应的两个实验装置图,请回答下列问题: (1)铜与稀硝酸反应的离子方程式______. (2)能否在I实验装置中用铜与稀硝酸反应制的较为纯净的NO气体______(填“能”或“不能”),简述理由______. (3)若用Ⅱ实验装置进行实验,以证明铜与稀硝酸反应生成的气体是NO,则:检查气密性的操作是______ 在烧杯中加入一定体积的稀硝酸,打开止水夹,用注射器慢慢抽取干燥管内的空气,稀硝酸沿着干燥管慢慢上升,直到充满整个干燥管,停止抽拉注射器,关闭止水夹,观察干燥管内的现象______.反应停止后,打开止水夹,用注射器抽取干燥管内的气体(事先已将注射器内原有的空气推出),关闭止水夹后取下注射器,并抽取一定量的空气,观察到的现象是______. (4)上述实验完成后,将注射器内的气体通入到NaOH溶液中,其目的是______. |
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“铜与稀硝酸反应的离子方程式”相关的问题
更多“铜与稀硝酸反应的离子方程式”相关的问题
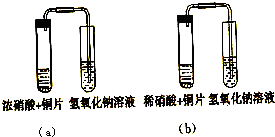
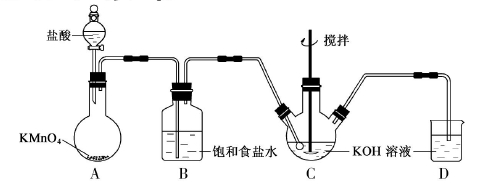
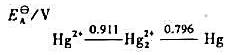
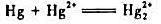 的平衡常数Kθ;
的平衡常数Kθ;















