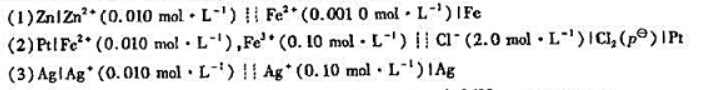题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
电池Pb|PbSO4(s)|Na2SO4·10H2O(饱和溶液)|Hg2SO4(s)|Hg在25℃时电动势为0.9647V,电动势的温度系数为1.74×10-
电池Pb|PbSO4(s)|Na2SO4·10H2O(饱和溶液)|Hg2SO4(s)|Hg在25℃时电动势为0.9647V,电动势的温度系数为1.74×10-4V·K-1。(1)写出电池反应;(2)计算25℃时该反应的△rGm,△rSm,△rHm及电池恒温可能放电时该反应过程的Qr,m。
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“电池Pb|PbSO4(s)|Na2SO4·10H2O(饱和溶…”相关的问题
更多“电池Pb|PbSO4(s)|Na2SO4·10H2O(饱和溶…”相关的问题
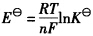 ,所以EΘ表示电池反应达到平衡时电池的电动势,对吗?
,所以EΘ表示电池反应达到平衡时电池的电动势,对吗?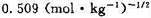 。试求:(1)电极反应和电池反应;(2)电池的标准电动势
。试求:(1)电极反应和电池反应;(2)电池的标准电动势 (要考虑γ±的影响);(3)按电池反应有2个电子得失,当反应进度为1mol时的
(要考虑γ±的影响);(3)按电池反应有2个电子得失,当反应进度为1mol时的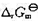 .
.